六步做好仓库环境监控
时间:2020-06-08 阅读:2435
制药行业作为关乎国民健康的重要行业,一直以来都受到国家的严格监管。从药品生产到运输储存,国家均有相应的法规条例予以规范。
随着技术的更新、药品生产化以及温度敏感性生物药品产量的增加,各国对药品质量的把控愈发严格,其中药品(原料药/成品药)的储存环节备受关注。美国、加拿大、欧盟、日本、澳大利亚及中国的药品生产质量管理规范(GMP)监管机构已要求对存放环境敏感性生命科学产品的仓库的温度与相对湿度状况进行“分布研究”。为帮助各位完成仓库或其他受监管贮藏空间的分布研究,在此推荐六个关键性步骤。
01
创建验证计划
验证主计划应包括:
• 确定验证目标。
• 确定质量、计量、及其他工作组在这一过程中的角色与责任。
• 确定包含工艺、设备及空间在内的验证活动。
• 制定文档及规程,其中包括假定温度或湿度发生偏差时公司如何响应。
• 明确验证时间表。
• 确立管理审批流程,尤其是针对诸如温度偏差超限之类的不良事件。
• 确认变更控制的方案,以明确在出现诸如设备维护、新基建、货架重新布置时需要重新验证。
02
鉴别风险区域
部分区域会因为时间或人员的流动产生较大的温差等,需要重点关注。比如一些靠近热源或冷源的位置或者是频繁搬运产品或设备的区域。
03
制定方案
在确认风险区域之后,将制定用于分布试验的方案。包括以下几点:
• 待生成数据的类型——例如温度、相对湿度、以及测量时间间隔。
• 所用传感器的数量及位置分布。
• 可接受的温度或相对湿度漂移量。
04
选择适当的技术
传感器应当是现代电子数据记录仪*的一部分。数据记录仪在验证试验的全过程对数据进行测量、存储和记录。随同数据记录仪使用的软件用以配置设备、下载数据。软件应当能够生成满足美国联邦规程法规(CFR)第11部分、欧盟委员会附件11以及其他包含在欧盟GMP第4章之内的所有要求的表格和图形报告。
在选择数据记录仪时,应查看以下特性:
• 误差来源min值——即测量不确定性低。
• 小幅温度变化敏感性。响应速度越快,数据点与测量时间越贴近。
• 长期稳定性,尤其是相对湿度传感器。其比温度传感器更易于发生漂移,质量较差的设备可能在每次使用前后均须进行校准。稳定性好、质量优的数据记录仪可在12个月或更长校准时间间隔内保持精度。这样既节约了时间,又因为消除了每次使用前后校准的需求而获得更好的测量结果。
• 在使用范围内的高精度。例如,维萨拉记录仪在工作范围-90至85°C内精度可达0.10°C,相对湿度精度可达百分之一。
•在量程内的校准的可溯源性。
•清晰、丰富、且可调阅查看的校准记录。

维萨拉DL2000系列温湿度记录仪
05
配置设备
在您确定了可能的风险区域并确定传感器分布之后,就可以开始配置设备,进行一系列的验证工作了。维萨拉可提供一个选装的GXP文件包,包括URS、FS、TM和RA,维萨拉提供的一个111页的IQOQ验证文档,包含了对软件和硬件的各项验证。


06进行试验和审核数据
您需要确定将要用于评估试验的报告信息。当试验完成时,软件将读取来自于数据记录仪的安全文件、显示所记录的数据、完成计算过程、并将选定用作分布试验报告的结论以图形方式输出。
试验文档通常显示如下信息:
• 标记有时间和日期的原始数据。
• 诸如min、max和平均温度之类的计算值。
• 试验期间所有传感器的图表。
• 仪器配置信息。
• 校准信息。
• 试验的日期与时间。
• 为审核与批准签字预留的空间。
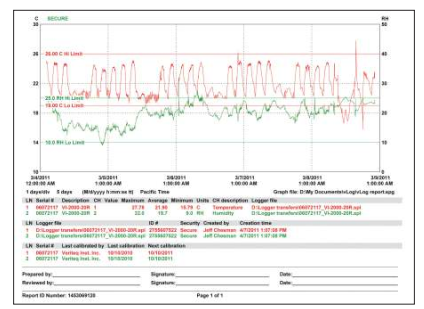
维萨拉分布试验报告可以显示上限和下限值,便于快速查看可接受的标准
*药企中有7家选择维萨拉的温湿度监控系统,2018年维萨拉在国内的23家客户,均顺利通过FDA及GMP审查。在日趋严苛的监管环境下,维萨拉愿为您护航,与您一同前行。
