融解曲线中那些令你头疼的问题,全面解析看这里!
我们在做染料法 SYBR Green qPCR时,除了要看扩增曲线的CT值大小外,另一个重要的指标是融解曲线是否为单峰。那您知道融解曲线是怎么来的吗?为什么说它是染料法 SYBR Green qPCR的重要指标之一呢?我们现在就来一起了解一下。
01,什么是融解曲线
要明确融解曲线的重要性,我们需要先知道染料法 SYBR Green qPCR的化学原理。
染料法 SYBR Green qPCR的体系中添加了一种DNA双链小沟结合染料, 即SYBR Green。它与DNA结合时发光,游离时不发光,所以每形成一条DNA双链,就会有一定数量的染料结合上去,就会产生荧光信号,信号强度与DNA分子总数目成正比。
但是SYBR Green 只是识别DNA 双链的小沟结构,当qPCR体系中存在非特异性产物时,SYBR Green 同样可以和这些非特异性产物的DNA双链结合发出荧光。所以仪器检测到的荧光值其实为qPCR目的产物与非特异性产物荧光值的总和,那得到的CT值自然是不准确的了。所以使用染料法qPCR,前提为qPCR扩增体系一定要特异。

qPCR扩增结束后,将温度逐渐升高至95℃,DNA双链也逐步解离为单链,DNA小沟结构逐步消失,SYBR Green 从双链中游离出来,荧光值降低。当温度达到 DNA 解链一半的温度时,也就是 Tm 值时,SYBR Green 会大量游离出来,荧光强度随之会出现突然下降,直至为0。这个反应荧光值变化的曲线即为融解曲线。

以ABI Q3软件的融解曲线程序设置为例(参见上图):所有的DNA单链在60℃下全退火形成双链后,温度逐渐升高至95℃(升温速度为0.15℃/sec),DNA双链逐渐解链为单链。仪器检测到该过程荧光信号的改变,即可得到融解曲线的荧光图谱。
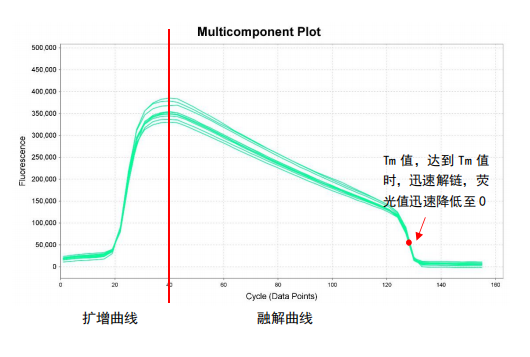
逐渐升温至95℃过程中,双链逐渐打开,荧光值高度下降
上图为扩增曲线与融解曲线的原始图谱,横坐标代表循环数,纵坐标代表荧光值。前40个循环即为扩增曲线,40个循环之后为融解曲线。可以看到随着循环数增加,荧光值逐渐下降,当到达Tm值时,剩余双链迅速解开,荧光值迅速降低至0。
但我们平时看到的融解曲线是下面的这张图谱。它是由融解曲线原始图谱上每个点取负倒数而得到的。其横坐标表示温度,波峰值对应的横坐标的温度值,即为Tm值。如我们图中所示的融解曲线的Tm值为87℃。
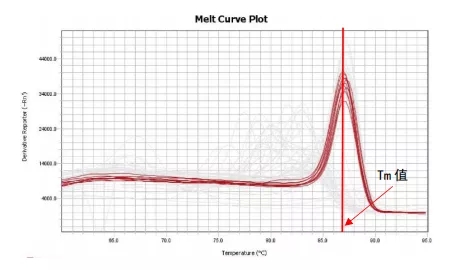
02,融解曲线的作用是什么
融解曲线的Tm值是融解曲线中的重要参数,在使用同一qPCR试剂下,目标基因融解曲线的Tm值是由其产物长度与GC含量决定的。目标基因的qPCR产物长度越长、GC含量越高,Tm值越大。不同的qPCR产物因其长度与GC含量不同,它们的Tm值大小也不一样。
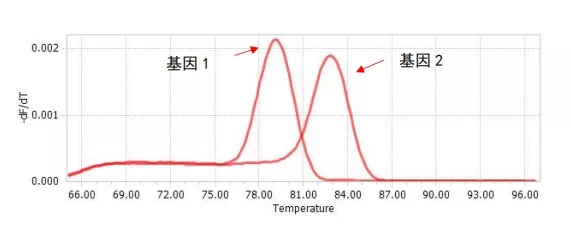
如下图所示,基因1 qPCR产物长度较基因2 qPCR产物短,那融解曲线表现出基因1的Tm值低于基因2的Tm值。
同理,如果qPCR扩增体系不特异,出现一个非特异性扩增产物,那qPCR产物即由目的产物与非特异性产物共同构成,因两者长度与GC含量不同,在融解曲线上会表现出两个Tm值,即两个波峰;若非特异性产物Tm值与目的条带的Tm值接近,融解曲线可能出现宽峰。
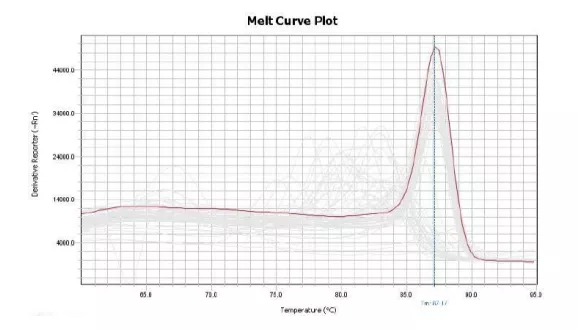
例2:杂峰/宽峰-qPCR产物不单一
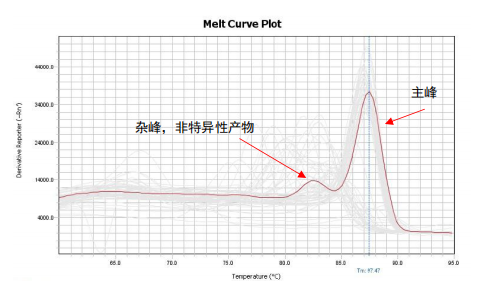
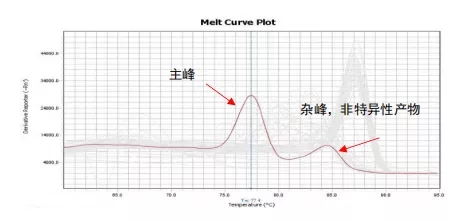
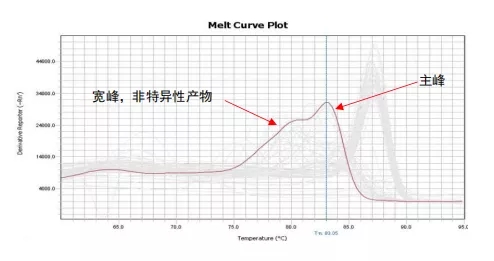
所以,通过判断基因的融解曲线峰形是否为单一窄峰,即可判定该基因qPCR扩增体系是否特异。染料法荧光定量,基因的融解曲线必须为单峰,定量结果才为准确。
03,如何去除融解曲线的杂峰
① 引物:如果引物设计不优,如引物设计软件得出的引物评分较低、引物扩增效率不满足90-110%,主要原因可能是引物本身质量不佳导致体系出现非特异性扩增。
解决方案:
重新设计引物,选择引物设计软件评分较高的2-3对引物进行合成,之后选择融解曲线无杂峰,扩增效率满足90-110%,且更接近100%的引物作为该基因的引物。
若该杂峰为引物二聚体引起,适当降低引物的投入量可以有效抑制引物二聚体的产生。
② 模板:cDNA模板存在基因组污染。
解决方案:
设计跨内含子引物进而避免基因组污染带来的干扰;或者选用带有基因组清除的逆转录试剂盒,逆转录前对RNA中混有的基因组进行清除。
③ CT值偏大:CT值≥30,可能是由于基因本身表达量低、或者扩增效率不满足90-110%而导致的基因CT值偏大。CT值较大的情况下,融解曲线容易出现杂峰。
解决方案:
如果基因扩增效率不满足90-110%,需要重新设计引物。
如果引物扩增效率满足90-110%,操作无问题的前提下,CT值≥30,说明基因本身的表达量很低,可以适当增加模板的投入量,若没有改善,可以更换为探针法。
